Les thérapies géniques en bref

Les chercheurs en génothérapie de Sanofi explorent de nouveaux moyens d’insérer les gènes thérapeutiques directement dans les cellules pour permettre à l’organisme de fabriquer de nouveau des protéines clés. Ces travaux ouvrent la voie à de nouveaux traitements pour soigner voire guérir des maladies pour lesquelles il n’existe que peu ou pas d’autres options thérapeutiques.
Virus adéno-associés : vecteurs de transfert d’ADN
Les thérapies géniques et cellulaires sont conçues pour traiter les maladies causées par un gène manquant ou défectueux. De nouvelles technologies peu coûteuses, comme l’édition de gènes CRISPR, ont permis de réparer des sections manquantes ou endommagées d’ADN, un peu comme si on utilisait la fonction copier-coller dans un document. En insérant une séquence d’ADN thérapeutique dans les cellules immunitaires, par exemple, il est désormais possible de renforcer la capacité du système immunitaire à détecter et à détruire les cellules tumorales.
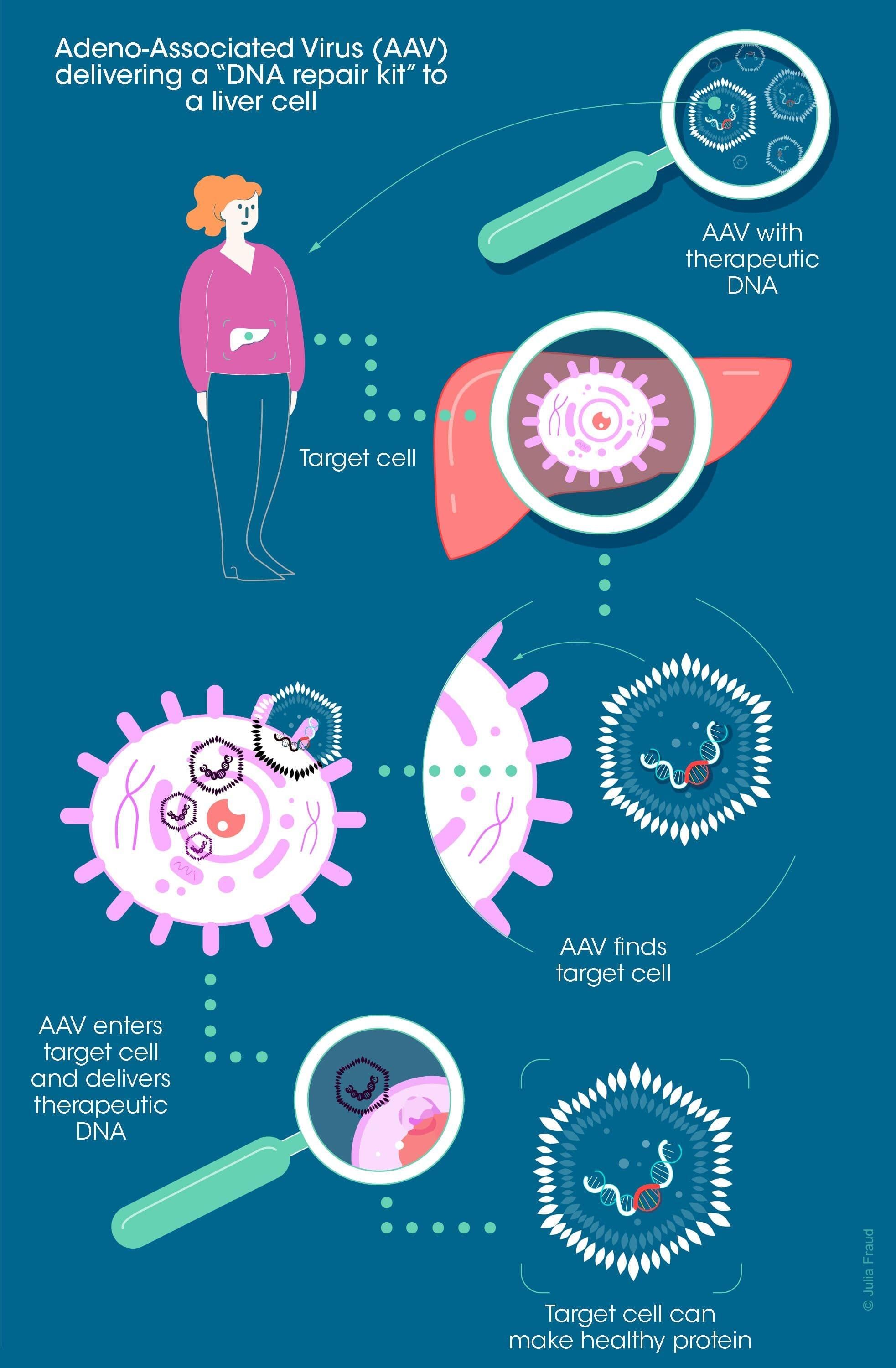
Pour pouvoir insérer un « kit de réparation de l’ADN » dans le génome d’une cellule, les scientifiques ont besoin d’un système de livraison sophistiqué. Pour y parvenir, ils exploitent la capacité naturelle des virus inactifs et non pathologiques à insérer de l’ADN dans les cellules hôtes.
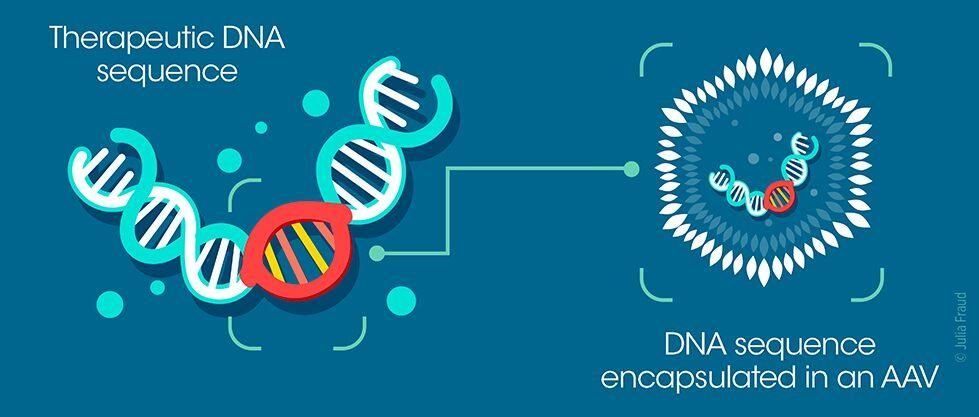
Les virus adéno-associés (AAV) sont un vecteur viable de transfert de gènes. Ils sont utilisés dans la recherche en thérapie génique car ils sont relativement simples à mettre au point. Ils peuvent être conçus pour transporter des séquences d’ADN thérapeutiques dans le noyau de différents types de cellules (hépatiques, musculaires, ou nerveuses par exemple).
La livraison de kits de réparation de l’ADN peut se faire directement dans le corps (thérapie génique « in vivo »), ou dans un échantillon de cellules du patient en laboratoire, qui sont réinjectées après réparation (thérapie génique « ex vivo »).
Toutefois, l’un des principaux obstacles aux AAV est le système immunitaire car il est capable d’identifier ces virus, de créer des anticorps pour les neutraliser et de les mémoriser. Si un AAV est introduit dans l’organisme pour la seconde fois, il se retrouve automatiquement confronté à des anticorps neutralisants qui l’empêcheront d’atteindre sa cible. C’est pourquoi les thérapies géniques sont considérées comme une solution à usage unique.
Une autre difficulté réside dans le fait que les AAV doivent livrer leur kit de réparation de l’ADN à des cellules spécifiques impliquées dans la maladie (cellules nerveuses ou musculaires par exemple), et ce, sans gaspiller la précieuse dose dans d’autres cellules, surtout si celles-ci se recyclent avant qu’on n’ait pu en tirer un quelconque bénéfice.
AAV et ingénierie de la capside
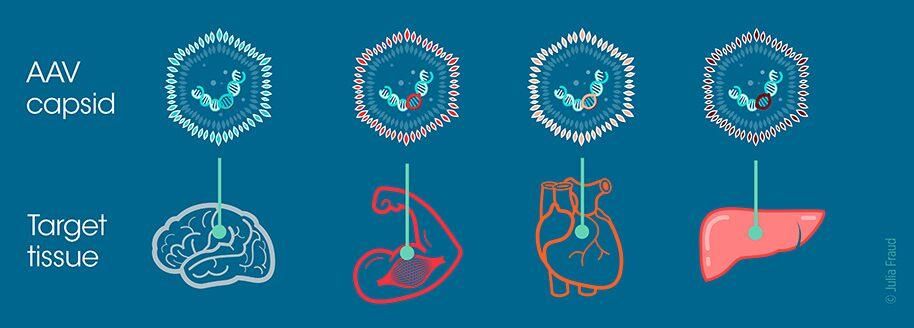
Pour résoudre ces deux problèmes, les chercheurs de Sanofi utilisent une plateforme technologique exclusive qui leur permet de concevoir une grande variété d’AAV. L’ingénierie des AAV capable de livrer de l’ADN thérapeutique s’articule autour de la capside : « enveloppe » protéique qui protège un génome viral. La capside d’un AAV détermine sa visibilité pour le système immunitaire et la facilité avec laquelle il peut délivrer son ADN dans différents types de cellules.
La capside ressemble à un ballon de football avec de petites pointes qui dépassent. Ces pointes aident l’AAV à interagir avec les protéines à la surface des cellules. Elles doivent être disposées de manière précise pour faciliter la détection de l’AAV et permettre de cibler un type de cellule en particulier. Leur agencement dépend d’une séquence spécifique d’acides aminés, modifiable en laboratoire.
Les chercheurs de Sanofi sont à la recherche de séquences spécifiques à la surface des capsides susceptibles d’aider les AAV à pénétrer dans certaines cellules et à en contourner d’autres. Cette approche de bio-ingénierie pourrait nous permettre d’élaborer des capsides capables de guider les thérapies géniques vers les les tissus cibles (tissus hépatiques, musculaires ou nerveux par exemple). Elle pourrait également donner lieu à la création d’une « flotte » d’AAV équipés pour livrer des kits de réparation de l’ADN. En effet, le fait de disposer de différentes capsides permettrait à l’AAV thérapeutique d’échapper à la réponse immunitaire, et ainsi de fournir plus d’une dose au patient.
« Pour mettre au point une capside dotée des caractéristiques dont nous avons besoin, nous concevons des milliers de générations de capsides en laboratoire sur une courte période », explique Sourav Choudhury, responsable des laboratoires Sanofi spécialisés dans les capsides et l’immunologie du transfert de gènes à l’aide de vecteurs AAV. « Nous recourons à l’IA et à la bioinformatique pour prédire les réactions de chacune d’elles – à quel point elles pourront faciliter l’acheminement de l’ADN d’un AAV vers un neurone par exemple. Autrement dit, nous reproduisons des millions d’années d’évolution en quelques jours de travail en laboratoire, et apportons des modifications mineures dans la séquence des acides aminés, qui peuvent conduire à des changements majeurs dans les capacités d’action d’une capside. »
Les capsides capables de cibler des cellules spécifiques à une maladie et de livrer leur cargaison de manière efficace présentent l’avantage supplémentaire qu’ils nécessitent un nombre bien inférieur d’AAV thérapeutiques par dose. Un plus indéniable pour la sécurité des patients, la fabrication et la recherche en cours.
Accélérer la médecine génomique
À l’heure actuelle, les équipes Sanofi de R&D en médecine génomique déploient une gamme de thérapies géniques pour répondre aux défis posés par les maladies génétiques rares et neurologiques, ainsi que certaines maladies courantes. De par ses capacités uniques en matière de R&D et de fabrication, la rationalisation de ses opérations et la mise en place de partenariats de premier plan, Sanofi est en mesure de développer des médicaments novateurs qui modifient les pratiques et peuvent profiter à la société tout entière.
En savoir plus

Les nouvelles frontières de la médecine génomique
Références
- Adachi K, Enoki T, Kawano Y, et al. Nat Commun 2014;5:3075
- de Alencastro G, Pekrun K, Valdmanis P, et al. Human Gene Therapy. 2020 May;31(9-10):553-564. DOI: 10.1089/hum.2019.339
- Jawa V, Terry F, Gokemeijer J, et al. Frontiers in Immunology. 2020 ;11:1301. DOI: 10.3389/fimmu.2020.01301
- Lisowski L, Dane AP, Chu K, et al. Nature 2014;506:382–386
