1, 2, 3 cibles ? Jusqu’à 5 sous-unités différentes de Nanobody® : vers un nouveau médicament ?
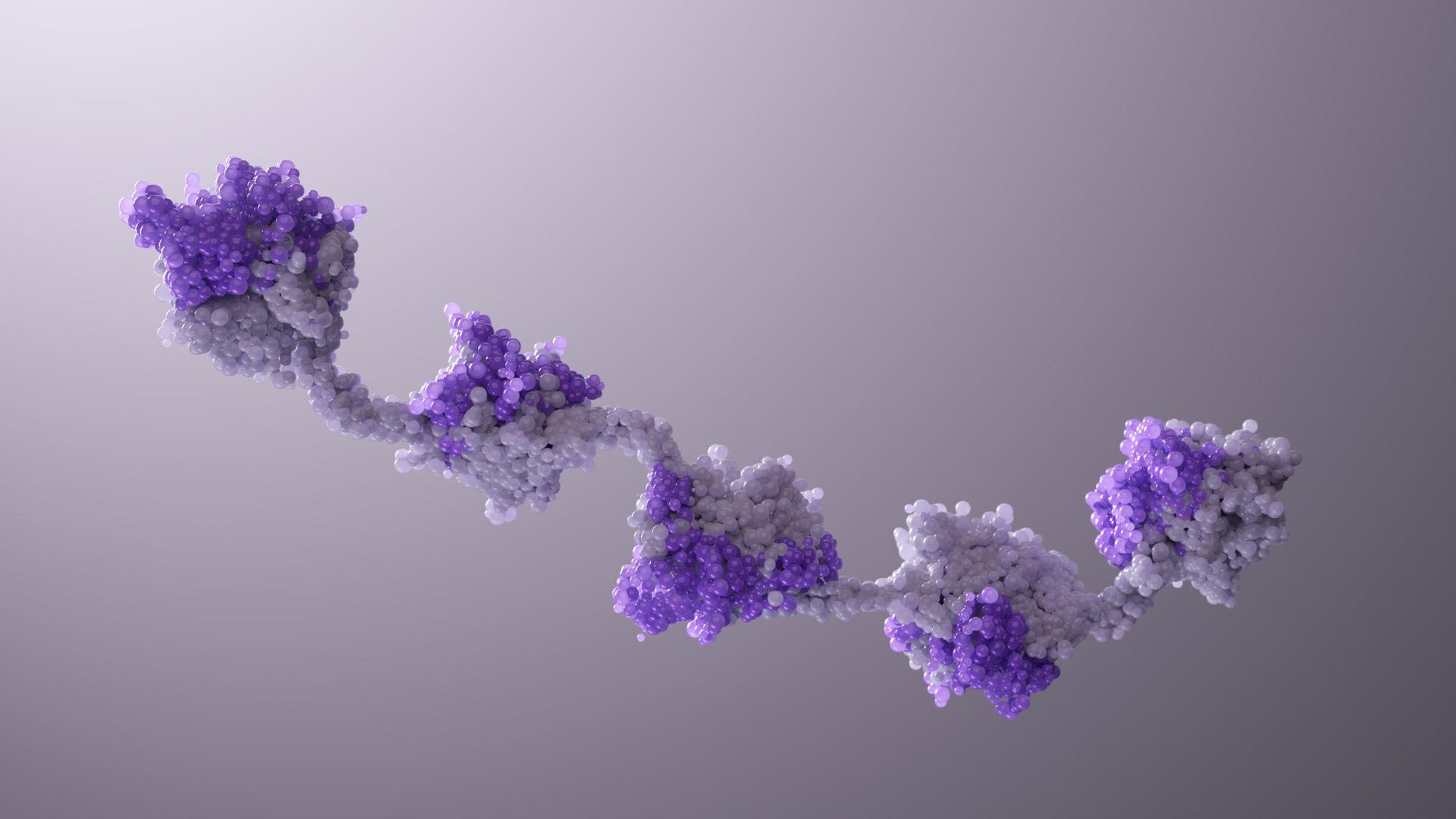
Grâce aux protéines NANOBODY®, découvertes dans du sang de chameau, petites et faciles à associer, les scientifiques réinventent la découverte de médicaments.
Il y a quelques années, un jeune homme d'une vingtaine d'années atteint d’une maladie génétique rare franchit la porte d'un laboratoire pharmaceutique avec une demande simple : un médicament qui lui sauve la vie.
« Il n’était même pas dans notre essai. Il attendait que le produit soit approuvé pour pouvoir le prendre," déclare Rebecca Sendak, vice-présidente senior et responsable de la plateforme globale de recherche sur les grandes molécules chez Sanofi. Elle a compris qu'il était urgent d'innover.
En regardant autour de moi, j'ai vu toutes ces personnes dans l'usine impliquées dans la fabrication de ce médicament, écoutant attentivement le récit de ce futur patient. Quel témoignage poignant…!

Rebecca Sendak
Vice-présidente senior et responsable de la plateforme globale de recherche sur les grandes molécules
Vingt ans plus tard, c’est le même sentiment d’urgence qui anime Sendak et son équipe chez Sanofi, qui travaillent sur les molécules NANOBODY®. Alors qu’elles ne font environ qu’un dixième de la taille des anticorps traditionnels, les protéines NANOBODY®, avec la même capacité de se lier des cibles spécifiques, elles peuvent être combinées comme sur un collier de perles. Leur petite taille et leur modularité permettent aux chercheurs d’imaginer de nouveaux médicaments pour des maladies complexes, faisant intervenir plusieurs voies de signalisation et signaux. Cette flexibilité représente une formidable évolution par rapport aux premiers jours des thérapies à base d’anticorps.
Les anticorps, leur découverte et leurs limites
Dans l’Allemagne de la fin du XIXe siècle, la progression de la diphtérie et du tétanos a engagé les chercheurs dans une véritable course aux traitements. En 1890, Emil von Behring et Shibasaburo Kitasato identifient enfin les bactéries responsables et décident d'en tester des formes atténuées sur des lapins et des cochons d’Inde, constatant alors que les animaux traités avaient développé une immunité protectrice. Ils ont ensuite découvert qu'en injectant le sang des bêtes immunisées à d’autres animaux, ceux-ci s’en trouvaient également protégés. Les deux hommes ont alors émis l’hypothèse que l’échantillon de sang renfermait une substance unique – baptisée ultérieurement « anticorps » – qui fonctionnait comme une antitoxine. Ainsi est née la recherche sur les anticorps.
Le fait d'avoir élucidé la structure des anticorps a valu à Edelman et Porter un Prix Nobel. Par la suite, ce sont Köhler et Milstein qui ont mis au point une technique permettant de fabriquer des anticorps issus d’animaux immunisés, permettant aux chercheurs d’obtenir des protéines d’anticorps purifiées susceptibles de se fixer à une cible unique et spécifique – l’anticorps « monoclonal ». Cette étape majeure dans l’utilisation thérapeutique des anticorps a également valu à Köhler, Milstein et Jerne un Prix Nobel.
L’impact des anticorps thérapeutiques n'a cessé de progresser depuis, avec la découverte de molécules capables de se lier à deux, voire trois cibles différentes. En 2022, plus de 162 médicaments à base d’anticorps avaient été approuvés dans le monde. Pourtant, il subsiste des problématiques médicales uniques à résoudre, qui dépassent les capacités des anticorps conventionnels.
« L’être humain est par définition très complexe, tout comme les maladies susceptibles de le toucher », indique Sendak. Si une pathologie fait intervenir plusieurs voies de signalisation et interactions, il faut aux scientifiques de nouveaux outils, capables de gérer plus d’interactions que les anticorps traditionnels. « Parfois, si on a affaire à deux voies de signalisation différentes, si on en bloque une, l’autre prend simplement le relais. » Une approche multicible peut répondre à des scénarios biologiques plus sophistiqués et ainsi bloquer deux voies à la fois, par exemple.
Sendak aimerait fabriquer une molécule capable d'aider le système immunitaire à combattre le cancer. « Il faut d’abord cibler une cellule cancéreuse, introduire une cellule immunitaire auxiliaire et l’amener ensuite à s’attaquer aux cellules cancéreuses – soit trois étapes différentes. » Dans ce cas, il faut rapprocher deux cellules différentes et déclencher simultanément une troisième action. Mais la configuration biologique peut rendre cet objectif difficile à atteindre et trop complexe pour des anticorps traditionnels.
La simple dimension de ces structures conventionnelles peut aussi poser problème lorsqu'il s'agit de mettre au point de nouveaux instruments thérapeutiques. Quand les chercheurs veulent combiner certaines parties de différents anticorps, « la molécule en question finit par grossir au point de devenir potentiellement ingérable », explique Sendak. Des anticorps trop volumineux peuvent aussi empêcher le principe actif d’atteindre sa cible. Enfin, ces grandes molécules, plus complexes, peuvent s'avérer plus difficiles à fabriquer.
Les scientifiques ont alors recherché un outil qui puisse remplir différents objectifs : relier plusieurs emplacements à la fois, tout en étant assez petit pour atteindre sa cible et assez simple pour être fabriqué de manière fiable. Ce sont ces travaux de recherche qui ont finalement abouti à la découverte des protéines NANOBODY®.
Des anticorps particulièrement minuscules et spécifiques

Différence structurelle entre un anticorps traditionnel en Y (composé de chaînes lourdes et légères) et un fragment de NANOBODY® plus petit et plus simple (constitué uniquement d’un seul domaine variable à chaîne lourde).
Plus d’un siècle après la découverte des anticorps, Raymond Hamers, de l’Université Libre de Bruxelles, rencontre un problème : dans son laboratoire, il manque de matériel d’expérimentation pour ses étudiants. Il retrouve dans son congélateur un échantillon de sang de chameau, réservé à d’autres recherches. Il décide d’en utiliser une partie pour satisfaire la curiosité de ses étudiants.
Mais en analysant les anticorps présents dans le sang du camélidé, les élèves font une « découverte incroyable », déclare Hamers. D’une manière générale, l’anticorps est en forme de Y et comporte deux chaînes légères et deux chaînes lourdes reliées. Or, le sang de chameau contient non seulement les anticorps habituels de la plupart des vertébrés, mais aussi un fragment unique et plus simple, dépourvu de chaînes légères. « Nous avons passé deux ans à vérifier notre constatation ». Les chercheurs ont aussi retrouvé ces petits anticorps chez d’autres espèces de camélidés, comme les lamas, les alpagas et les vigognes. Ils ont estimé que ces petites protéines variables, apparentées à des anticorps et qualifiées de modules NANOBODY®, pourraient avoir une utilisation thérapeutique.
Vers une ère thérapeutique nouvelle, « multivalente »
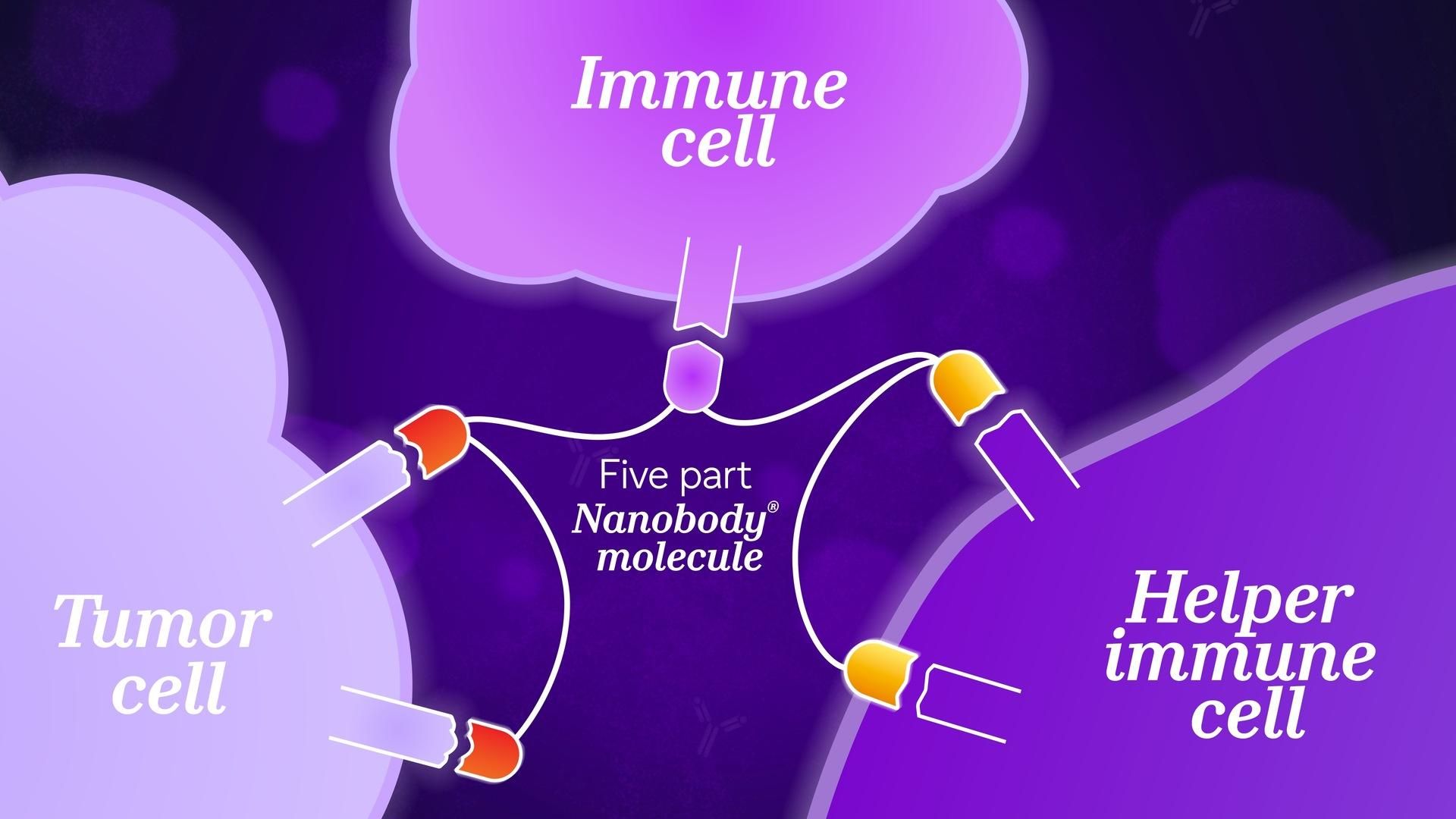
Plusieurs modules NANOBODY® reliés les uns aux autres par un fil comme un « collier de perles », avec des connecteurs personnalisables et des lieurs flexibles. Ce format multi-ciblage est issu de la biologie computationnelle et de l'ingénierie protéique, avec modélisation prédictive, synthèse, assemblage modulaire et évaluation stricte.
Les protéines NANOBODY® offrent une flexibilité sans précédent ! On parle du modèle du « collier de perles » pour désigner une molécule unique qui peut être reliée à une autre par différents connecteurs, avec leurs propres capacités géométriques. Ce design est infiniment souple et modulable. « Parfois, les cibles visées sont éloignées les unes des autres, et il faut une très longue liaison. Si, au contraire, elles sont proches les unes des autres, on aura besoin d'une liaison plus courte," ajoute Sendak. Cette flexibilité permet de régler la structure d’une molécule NANOBODY® en fonction de différentes cibles et de différentes exigences géométriques.
La durabilité est également une propriété modulable. « Il arrive qu'on ait besoin qu'une substance reste longtemps dans l'organisme pour ne pas avoir à la doser aussi fréquemment. Dans d'autres cas, on peut souhaiter l’élimination du médicament dès qu'il a rempli sa fonction. » Si les anticorps traditionnels peuvent circuler deux semaines dans le corps humain, les molécules NANOBODY® disparaissent naturellement de l'organisme en quelques jours, à moins d’être remaniées pour y demeurer plus longtemps.
L’utilisation thérapeutique des protéines NANOBODY®
Le premier médicament issu de modules de NANOBODY®, développé par Ablynx (qui fait désormais partie de Sanofi), a été approuvé en 2018 contre un trouble rare et grave de la coagulation sanguine. Les scientifiques de Sanofi ont acquis des années d’expérience grâce à cette technologie, accélérant ainsi l’innovation future.
L'équipe de Sendak teste une structure utilisant sept sous-unités de NANOBODY®. Elle précise qu'un tel degré de multi-ciblage est beaucoup plus avancé que celui que Sanofi a pu atteindre lors de l'acquisition de cette plateforme.
Nous continuons de repousser les limites s'agissant du nombre de cibles que nous pouvons atteindre. Tout ceci n'est possible que par un processus de tâtonnements : ne jamais cesser de développer, voir ce qui fonctionne ou pas et comment aller plus loin.
Rebecca Sendak
Vice-présidente senior et responsable de la plateforme globale de recherche sur les grandes molécules
Pour vérifier que la technologie des protéines NANOBODY® fonctionne comme prévu, l’équipe de Sanofi adopte une approche prudente. Il lui faut procéder à des criblages positifs et négatifs pour contrôler que la molécule présente les caractéristiques voulues. « Il faut détruire les cellules cancéreuses sans activer une autre population », explique-t-elle. Pour ce faire, l’équipe de Sendak teste différentes briques de construction, leur ordre, ainsi que les différents types et longueurs de lieurs, dans diverses permutations. Les tests de criblage fonctionnel confirment que l’on est en train de produire l’action recherchée en évitant les effets indésirables.
Un avenir complexe, largement fondé sur le calcul
À mesure que l'on rajoute des modules NANOBODY® au « collier de perles », avec différentes possibilités de liaisons, les interactions moléculaires se font de plus en plus complexes. Le nombre de combinaisons possibles augmente de manière exponentielle, alors qu’il n’est pas toujours possible ou efficace de ne procéder que par tâtonnements. L’ensemble des possibilités envisageables dans la conception de médicaments biologiques complexes est quasiment infini, et même avec toutes les capacités de ciblage à haut débit que Sanofi a déployées, il n’est pas réaliste de tester expérimentalement toutes les formules possibles. C’est pourquoi Sanofi a intégré des outils informatiques de calcul prédictif dans son flux de travail de conception de molécules. « Nous avons une approche de criblage virtuelle qui peut prédire comment ces molécules se lieront, ainsi que d’autres méthodes computationnelles pour s’assurer que les composés présenteront un comportement biophysique approprié, permettant au composé d’être développé comme un médicament utile pour le patient » décrit Sendak. Ce faisant, ces outils computationnels réduisent le champ des tests à effectuer avec des expériences physiques, ce qui permet de raccourcir les délais de développement jusqu’à six mois.
Pour Sendak, il est assez particulier de voir la manière dont une plateforme a ouvert le champ des possibilités pour venir en aide aux patients. « Le fait que tous ces nouveaux outils se voient offrir la possibilité d’être utiles aux patients est tout simplement fabuleux. »
NANOBODY® est une marque déposée d’Ablynx N.V.
Contenus liés
La plateforme technologique NANOBODY® de Sanofi
Repenser la recherche sur les maladies rares
Références
- Verheijden, K. L. M. et al. "Antibody challenges: Overcoming limitations in therapeutic antibody development." Current Opinion in Structural Biology vol. 94 (2025): 102766. doi:10.1016/j.sbi.2025.102766
- de Quadros, S. L. C. R. et al. "Diphtheria and tetanus toxoid vaccines: a review of the history, development, and current use." Revista da Sociedade Brasileira de Medicina Tropical vol. 50,1 (2017): 10-19. doi:10.1590/0037-8682-0430-2016
- The Nobel Prize (1972). The Nobel Prize in Physiology or Medicine 1972 Press Release. Accessed 29 October 2025. Available at https://www.nobelprize.org/prizes/medicine/1972/press-release/
- Biomol. The Invention of the Hybridoma Technology. Accessed 29 October 2025. Available at https://resources.biomol.com/biomol-blog/invention-of-the-hybridoma-technology
- New Scientist (2007). The camel factor: Nanobody revolution. Accessed 29 October 2025. Available at https://www.newscientist.com/article/mg19626241-600-the-camel-factor-nanobody-revolution/
- Al-Hajj, M. A. A. et al. "Therapeutic monoclonal antibodies: An update on their mechanisms of action and clinical applications." Frontiers in Immunology vol. 13 (2022): 953526. doi:10.3389/fimmu.2022.953526