Les immunothérapies ont montré leur efficacité dans le traitement ciblé du cancer, mais nous n'en sommes qu'au début. Nos équipes d'immuno-oncologie utilisent l'immunoscience pour mieux détecter et attaquer les tumeurs, en adoptant des approches plus ciblées qui arment le système immunitaire contre le cancer sans déclencher de réponses immunitaires indésirables.

Notre portefeuille de produits oncologiques
Nous comptons plus d'une douzaine de molécules de nouvelle génération en clinique, chacune ayant un mécanisme d'action distinctif contre les hémopathies malignes ou les tumeurs solides.
Poursuivre la science
Nos équipes de R&D poursuivent la science afin de trouver des traitements pour les personnes atteintes d'un cancer.

Voices from the Lab: Nizar El Murr sur l’immuno-oncologie
Sanofi lutte contre le cancer sur plusieurs fronts
John Reed et Frank Nestle expliquent comment nous construisons un portefeuille de R&D pour pallier les lacunes critiques en matière de soins contre le cancer
Renforcement du système immunitaire
Nos équipes d'immuno-oncologie travaillent sur des méthodes visant à stimuler le système immunitaire afin de mieux détecter et attaquer les tumeurs. Enfin, nos équipes d'oncologie moléculaire conçoivent des médicaments de précision puissants pour détruire les cellules cancéreuses ou activer localement les cellules immunitaires.
Repenser le développement de traitements oncologiques
Notre culture de collaboration permet à nos équipes d'obtenir des changements significatifs pour les personnes qui luttent contre le cancer.

Plateformes technologiques
A l’aide de plateformes technologiques de pointe, nous avons redéfini notre champ d’action en oncologie, élargissant nos capacités dans les domaines de l’immuno-oncologie, de l’oncologie moléculaire et de la médecine génomique

Collaboration
Afin d’aller plus loin dans notre vision ambitieuse de générer plusieurs candidats chaque année, nous collaborons avec des partenaires innovants pour faire avancer la recherche en oncologie.

Approche centrée sur le patient
En écoutant, en apprenant et en gardant les patients au cœur de tout ce que nous faisons, nous pouvons faire avancer la science et faire une différence durable dans la vie des gens.
En savoir plus sur l'oncologie
Une lutte sur tous les fronts contre le cancer
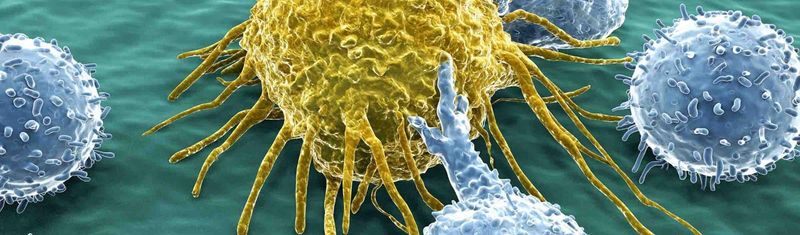
Notre engagement en oncologie

Votre santé : oncologie
Nos dernières actualités
26 janvier 2026
1, 2, 3 cibles ? Jusqu’à 5 sous-unités différentes de Nanobody® : vers un nouveau médicament ?
Plus d'informations pour les professionnels de la santé
Nos engagements en matière de partage de données
Nos engagements de partage de données relatives aux essais cliniques et leurs résultats
Trouver un essai clinique Sanofi
Campus Sanofi
En savoir plus
- LaMarche MJ (2022) Think Biologically, Act Chemically. J Medicinal Chem; DOI: 10.1021/acs.jmedchem.2c01121
- Manandhar M, Chun E, Romesberg FE (2021) Genetic Code Expansion: Inception, Development, Commercialization. J Am Chem Soc 143:4859-4878; DOI: 10.1021/jacs.0c11938
- Mitra-Kaushik S, Mehta-Damani A, Stewart JJ, et al. (2021) The Evolution of Single-Cell Analysis and Utility in Drug Development. AAPS J 23:98; DOI: 10.1208/s12248-021-00633-6