Grâce à des technologies de rupture et des plateformes de développement de nouvelle génération, enrichies par l'intelligence artificielle (IA), nous créons des plateformes thérapeutiques qui alimenteront notre pipeline aujourd'hui et pour les années à venir.
Domaines d'innovation
Technologies computationnelles
Chaque étape de notre processus de R&D a subi une profonde transformation numérique. Nous avons intégré l'IA pour converger les données, profiler les maladies et mieux prédire quelles molécules précoces ont le plus grand potentiel en tant que médicaments. En associant la technologie à notre expertise approfondie en immunoscience, nous générons des insights plus précis et plus rapides, pour accélérer la recherche, rationaliser le développement et permettre à nos scientifiques de se concentrer sur les problèmes qui comptent le plus pour les patients.
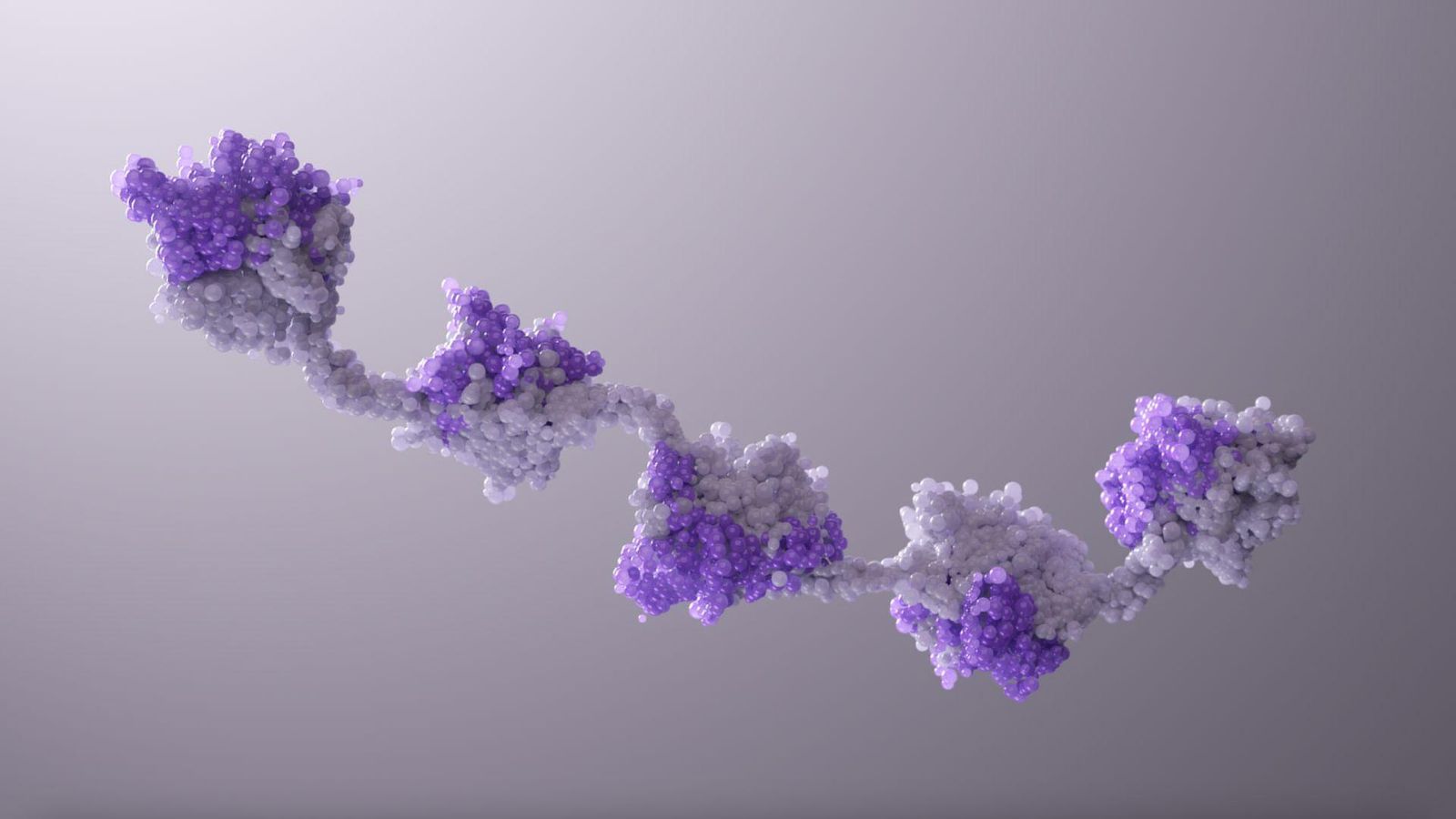
Technologies à médiation immunitaire
Nous mettons à profit nos décennies d'expertise pour transformer les molécules biologiques en médicaments pour les maladies neurologiques, les conditions immuno-inflammatoires et divers types de cancers. Notre portefeuille comprend :
- Des anticorps multi-spécifiques, capables de reconnaître plusieurs cibles en une seule thérapie pour attaquer une maladie sur plusieurs fronts.
- Des molécules NANOBODY®, conçues pour atteindre de nouvelles cibles de maladies auparavant inaccessibles et dépasser les plafonds d'efficacité des thérapies existantes.
- Des activateurs de cellules NK, destinés à aider à combattre le cancer sans déclencher une réponse immunitaire excessive.
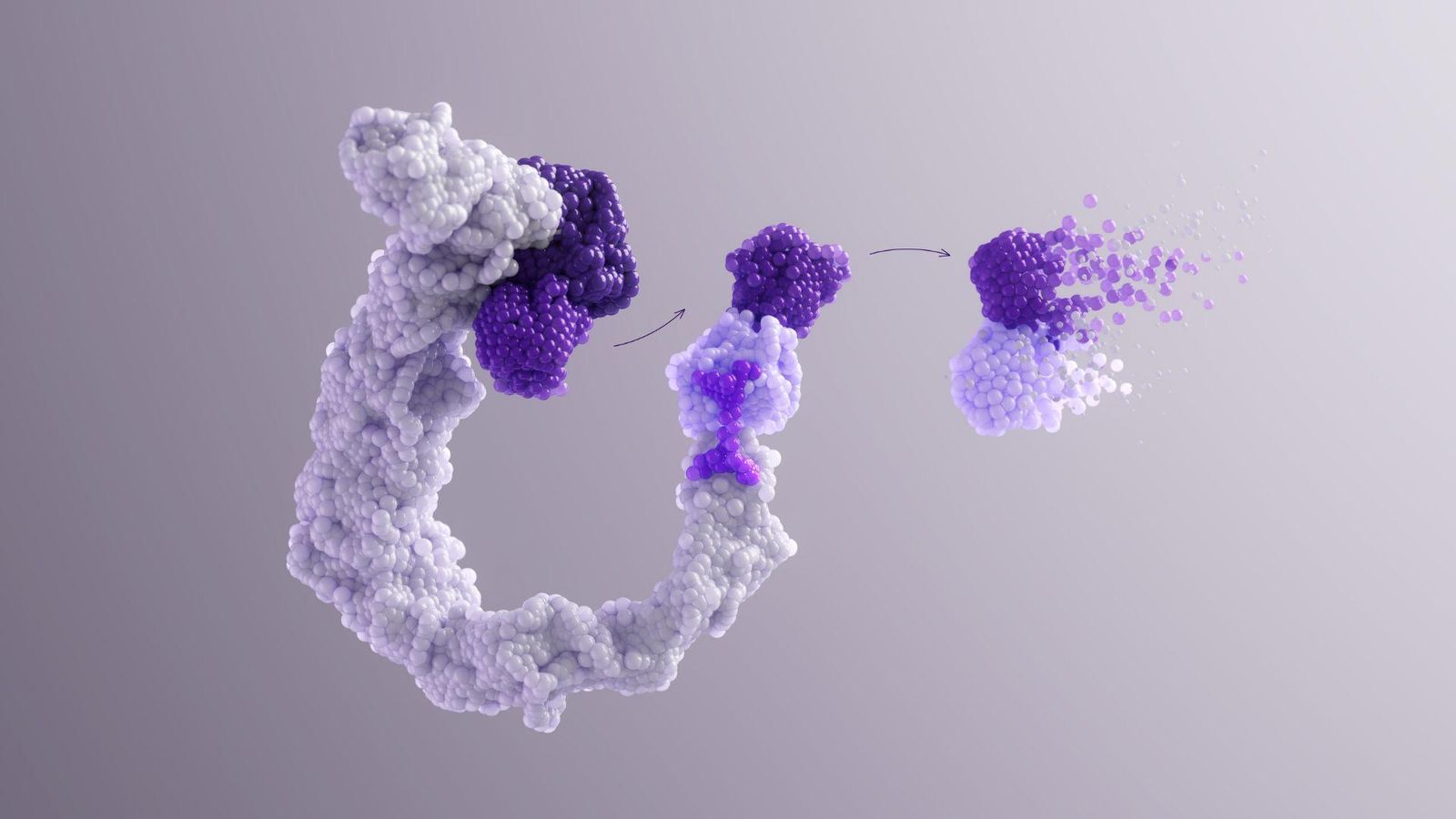
Dégradation ciblée des protéines
Notre compréhension approfondie de la biologie cellulaire nous pousse à explorer les mécanismes naturels du corps pour éliminer les agents pathogènes à l'intérieur des cellules. De nombreuses maladies sont causées par le dysfonctionnement de certaines protéines impliquées dans la réponse immunitaire. En exploitant la capacité naturelle des cellules à dégrader les protéines anciennes ou endommagées et en ciblant ces protéines pathogènes, nous pouvons potentiellement stopper leur activité et atténuer les maladies.
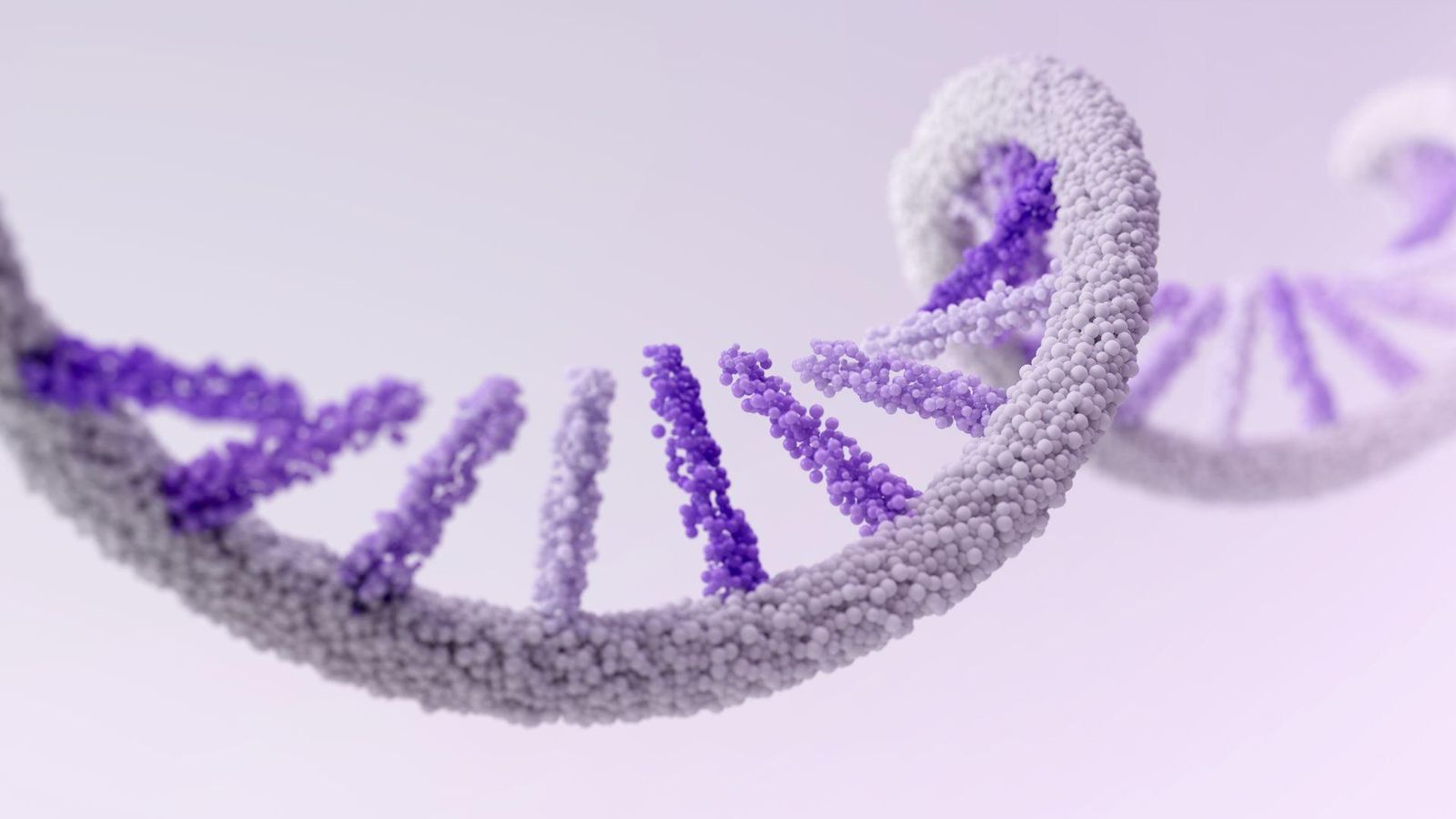
ARNm
Nous ouvrons la voie à la prochaine génération de technologies de vaccins et de plateformes thérapeutiques avec l'ARN messager (ARNm). Cette technologie a le potentiel d'utiliser les mécanismes naturels du corps pour assembler les protéines nécessaires à la lutte contre les maladies. Il peut s'agir de protéines qui stimulent le système immunitaire à produire des anticorps contre les envahisseurs dans le cas des vaccins, ou de protéines qui agissent comme des thérapeutiques dans le corps. Nous nous appuyons sur notre héritage en matière de vaccins pour étendre ce potentiel au cancer et aux maladies rares difficiles à traiter.
De la technologie à la thérapeutique
Découvrez l'étendue de nos plateformes technologiques innovantes.
Vaccins au-delà de l'ARNm
Nos vaccins sont aussi divers que les maladies qu'ils aident à prévenir. Nos technologies vont des vaccins inactivés et vivants atténués aux vaccins à protéine recombinante ou à base de polysaccharides.
- Les vaccins vivants atténués, basés sur des virus entiers affaiblis, aident le corps à renforcer ses défenses sans provoquer de maladie.
- Les vaccins à protéine recombinantes, fabriqués en produisant des protéines spécifiques d'un pathogène en laboratoire et en les formulant en vaccin.
En savoir plus sur nos technologies innovantes