Cibler la neuroinflammation chez les patients atteints de sclérose en plaques
La sclérose en plaques (SEP) est une maladie chronique et invalidante qui touche plus de 2,3 millions de personnes à travers le monde. Nous avons demandé à Tim Turner, responsable monde du programme de neurologie chez Sanofi, d’évoquer les principaux défis de la recherche en matière de SEP.
L’inflammation est un phénomène observé dans de nombreuses maladies, et la neurologie n’y fait pas exception. C’est pourquoi chez Sanofi, nos équipes de R&D se concentrent sur l’élaboration de médicaments capables de cibler la neuroinflammation : réponse immunitaire hyperactive qui entraîne l’inflammation et la progression de la maladie au-delà de la barrière hémato-encéphalique.
Il y a tout juste trente ans, il n’existait aucun traitement approuvé contre la SEP. Aujourd’hui, plus d’une dizaine de thérapies modificatrices de la maladie sont à disposition des patients. Il a été prouvé que celles-ci réduisent la fréquence des poussées, et même l’accumulation des handicaps. Cette évolution reflète les progrès majeurs réalisés dans notre compréhension des réponses immunitaires à l’origine de la maladie. Le grand défi de la recherche sur la sclérose en plaques consiste désormais à maîtriser le processus pathologique au sein même du système nerveux central (SNC) ainsi qu’à l’extérieur de celui-ci afin de stopper la progression de la maladie.

Par Timothy J. Turner, responsable monde du programme de neurologie chez Sanofi
Impact de la SEP sur le cerveau
Chez les patients atteints de SEP, le système immunitaire s’attaque aux tissus sains et provoque des lésions au cerveau ainsi qu’à la moelle épinière pour des raisons encore inconnues. Cette attaque auto-immune se caractérise notamment par les dommages qu’elle cause à la myéline à l’intérieur du SNC. Cette gaine protectrice entoure les longs axones qui, tels des câbles, transportent les signaux électriques entre neurones, lesquels transmettent les informations de cerveau aux autres parties du corps via un gigantesque réseau.
La neuroinflammation brise la myéline selon un procédé que l’on appelle la démyélinisation, ce qui peut causer des dommages à l’axone et ainsi couper la connexion entre neurones. Ces processus dégénératifs peuvent commencer très tôt dans la SEP, avant que le patient - ou un membre de son entourage ne détecte les premiers signes de la maladie, tels qu’un manque de coordination ou des difficultés à marcher.

Donner un nouvel espoir aux personnes atteintes de sclérose en plaques
Dov, jeune homme atteint de SEP en Israël, inspire le travail des scientifiques pour améliorer les thérapies et relever les défis de la recherche
Comment la neuroinflammation commence
L’activité des cellules immunitaires est incessante à l’intérieur du cerveau : les cellules immunitaires résidentes assurent un entretien de routine pendant que les cellules immunitaires périphériques traversent la barrière hémato-encéphalique pour effectuer une « veille immunitaire ». Chez les patients atteints de SEP, ces deux types de cellules peuvent devenir agressives et dysfonctionnelles :
- Les lymphocytes T, les lymphocytes B producteurs d’anticorps et les autres cellules immunitaires qui traversent la barrière hémato-encéphalique peuvent s’attaquer au cerveau et à la moelle épinière.
- À l’intérieur et à l’extérieur du SNC, les lymphocytes B libèrent des substances appelées cytokines qui déclenchent une inflammation.
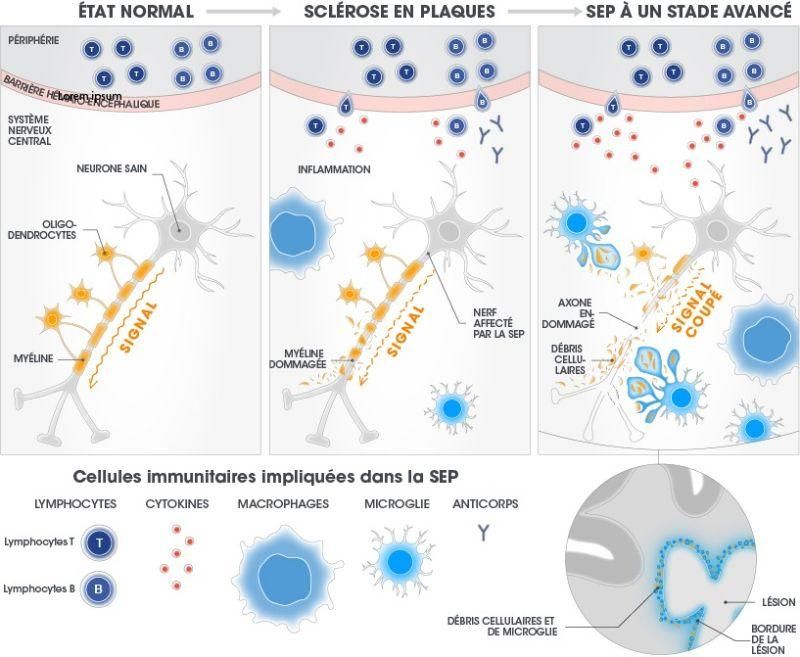
La microglie patrouille régulièrement dans le cerveau pour maintenir un environnement « propre ». Chez les patients atteints de SEP, elle s’emballe et endommage la myéline. Cela crée des débris, et la microglie réagit. Les lésions composées de microglie, de débris de myéline et d’autres cellules s’accumulent en bordure de lésion, où elles peuvent être détectées à l’aide de techniques d’IRM avancées.
Lésions chroniques
Les dommages résultant de cette réaction en chaîne dans le cerveau peuvent être détectés à l’aide de techniques d’IRM avancées : ils se présentent sous forme de lésions composées de cellules immunitaires et de débris de myéline, qui s’accumulent en bordure. Les axones peuvent alors s’en trouver :
- remyélinisés ;
- inactivés sans être remyélinisés ; ou
- poursuivre leur dégénérescence.
Certaines lésions présentent le terreau idéal pour que s’y déclenche une inflammation chronique qui « couvait » dans le cerveau. Ces lésions persistantes s’accompagnent d’une perte de volume cérébral, de l’apparition de handicaps et d’une progression de la maladie.
Aggravation des dommages
Quand les cellules du SNC sont détruites, les débris qui en résultent attirent l’attention des cellules immunitaires innées telles que la microglie, qui jouent normalement un rôle de « nettoyage » à l’intérieur du SNC. Malheureusement, cela peut causer des dommages supplémentaires.
La microglie, présente dans le cerveau et la moelle épinière, joue un rôle actif d’entretien du SNC. Parmi ses nombreuses fonctions bénéfiques, elle repère les signes de dommages cellulaires ou d’agents pathogènes susceptibles de déclencher une réponse innée. Chez les patients SEP, cette fonction protectrice devient destructrice : les débris issus de la démyélinisation entraînent un emballement de la microglie et une destruction des tissus normaux. Ce processus neuroinflammatoire peut causer une destruction encore plus importante de la myéline. Il crée un environnement hostile et empêche les processus de réparation qui favoriseraient la remyélinisation en temps normal.
Pour limiter ou réparer les dommages, il est essentiel de trouver des moyens de freiner cette réaction en chaîne. Toutefois, la microglie étant présente dans le SNC, les thérapies potentielles doivent traverser la barrière hémato-encéphalique pour agir efficacement.
Traverser la barrière hémato-encéphalique
La barrière hémato-encéphalique exerce un contrôle étroit sur tout ce qui entre ou sort du SNC. C’est pourquoi la plupart des traitements contre la SEP, notamment les thérapies par anticorps, sont conçus pour cibler les cellules situées en dehors du SNC : empêcher les lymphocytes T et B indésirables de pénétrer dans le cerveau peut en effet limiter certaines activités dégénératives à l’intérieur du cerveau.
L’élaboration d’un traitement capable de traverser la barrière hémato-encéphalique et de pénétrer le SNC afin d’agir directement sur les cellules immunitaires constitue un obstacle majeur à l’avancée des recherches chez Sanofi. Mais plus nous approfondissons notre connaissance de la SEP, plus nous pouvons axer nos efforts sur des cibles spécifiques dans le cerveau qui étaient inaccessibles auparavant.
Cibler la BTK
Pour qu’un médicament puisse pénétrer le SNC, il doit échapper au système sentinelle de l’organisme, qui empêche toute substance indésirable d’entrer dans le cerveau. À l’heure actuelle, les chercheurs de Sanofi explorent la possibilité de cibler une enzyme appelée tyrosine kinase de Bruton (BTK Bruton’s tyrosine kinase).
La BTK est essentielle à l’activation de nombreuses cellules immunitaires à l’origine de la SEP, telles que les lymphocytes B et la microglie. Elle intéresse les chercheurs car elle joue un rôle central dans les activités immunitaires des deux côtés de la barrière hémato-encéphalique. C’est pourquoi nous pensons qu’un traitement permettant d’inhiber la BTK dans le cerveau pourrait calmer l’activité de la microglie et d’autres cellules immunitaires, et les ramener à un état plus normal.
Nos équipes de neurologie étudient un inhibiteur de BTK conçu pour traverser la barrière hémato-encéphalique chez l’humain. Nous pensons que le blocage de la BTK dans le SNC peut moduler la microglie et les lymphocytes B à l’intérieur du cerveau, et ainsi les réguler dans le SNC. Cela pourrait réduire l’impact de la maladie chez les personnes atteintes de SEP, et améliorer grandement la qualité de vie des patients.
Timothy J. Turner
Responsable monde du programme de recherche sur les inhibiteurs de BTK chez Sanofi
Perspectives d’avenir
La communauté scientifique a compris depuis les années 1870 que la SEP est une maladie démyélinisante du cerveau, mais ce n’est que récemment qu’il est devenu possible de cibler les cellules immunitaires hyperactives dans le cerveau. De nouvelles approches chimiques et de nouvelles méthodes reposant sur des protéines « navettes » permettant de traverser la barrière hémato-encéphalique ont redéfini les attentes quant aux possibilités de la recherche en neurologie. Nos équipes se basent sur ces nouvelles technologies pour mettre au point une nouvelle génération de thérapies qui auraient été absolument inaccessibles il y a seulement dix ans. Nous vivons une période absolument passionnante pour la recherche.
Timothy J. Turner, responsable monde du programme de neurologie chez Sanofi
En savoir plus

Soutenir les enfants dont les parents sont atteints de sclérose en plaques

Plateformes technologiques
R&D sur les maladies neurologiques
Références
- Franklin, R., ffrench-Constant, C (2008) Remyelination in the CNS: from biology to therapy. Nat Rev Neurosci 9:839–855; doi: 10.1038/nrn2480
- Li R, Patterson KR, Bar-Or A (2018) Reassessing B cell contributions in multiple sclerosis. Nat Immunol 19:696–707; doi: 10.1038/s41590-018-0135-x
- Liddelow SA, et al. (2017) Neurotoxic reactive astrocytes are induced by activated microglia. Nature 541:481-487; doi: 10.1038/nature21029
- Ludwin SK, Rao VTs, Moore CS, Antel JP (2016) Astrocytes in multiple sclerosis. Mult Scler 22:1114-1124; doi: 10.1177/1352458516643396
- Reich DS, Lucchinetti CF, Calabresi PA (2018) Multiple Sclerosis. N Engl J Med 378:169-180; doi: 10.1056/NEJMra1401483
- Reich DS, et al. (2021) Lancet Neurol 20:729-238; doi: 10.1016/s1474-4422(21)00237-4
- Trapp BD, et al. (1998) Axonal transection in the lesions of multiple sclerosis. N Engl J Med 338:278-285; doi: 10.1056/NEJM199801293380502
- Weber ANR, et al. (2017) Bruton’s tyrosine kinase: an emerging key player in innate immunity. Front Immunol 8:1454; doi: 10.3389/fimmu.2017.01454
- Werneburg S, et al. (2020 Immunity 52:167-82.e7; doi: 10.1016/j.immuni.2019.12.004
- Wiendl H, Gross CC (2013) Nat Rev Neurol. 9:394-404; doi: 10.1038/nrneurol.2013.95